
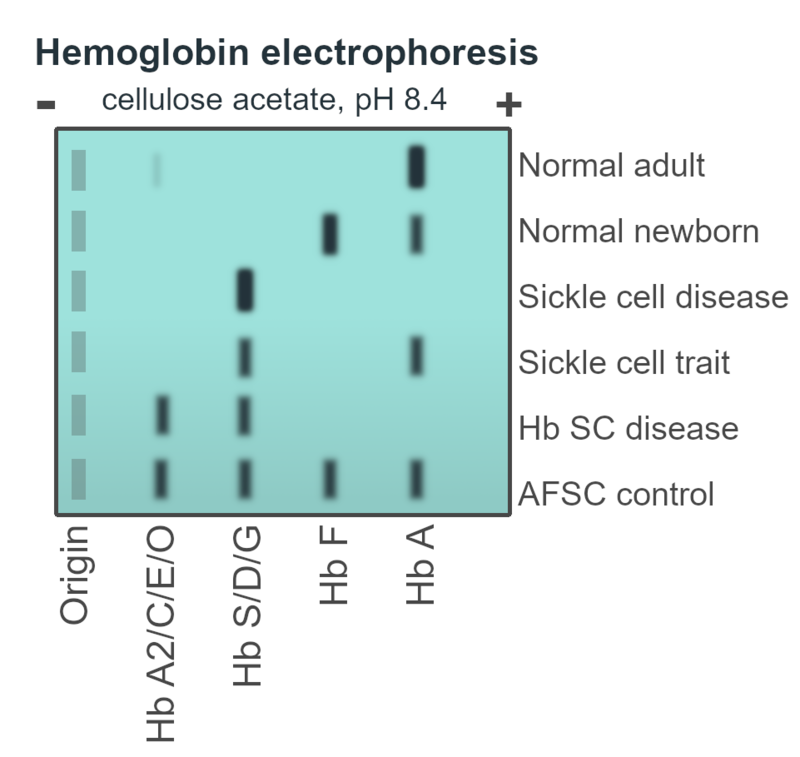
• جهت انجام تست هموگلوبین الکتروفورز با روش¬های ژل¬-الکتروفورز الزاماً باید با بیش از یک نمونه، الکتروفورز انجام شود و حداقل یک نمونه نرمال به عنوان نمونه شاهد در نظر گرفته شود، زیرا ممکن است به عنوان مثال نمونه بیمار 100 درصد دارای هموگلوبین F باشد و با هموگلوبین A1 اشتباه گرفته شود.
• حداقل فاصله بین باند هموگلوبین A1 و A2 باید 10تا 12 میلی¬متر باشد. اگر این فاصله کمتر باشد ممکن است هموگلوبین¬هایی که نزدیک به هم حرکت می¬کنند مثل هموگلوبین A1 وF و یا هموگلوبین A2 وC.S (Constant Spring) با هم ادغام شوند و نتوان آنها را از یکدیگر جدا نمود.
• همیشه ژلِ الکتروفورز را بعد از اتمام مراحل انجام تست الکتروفورز و قبل از اسکن نمودن با دستگاه، حتما از جهت وجود باند¬های غیر طبیعی به صورت چشمی بررسی نمایید، زیرا ممکن است این باند¬ها به دلیل غلظت کم، توسط اسکنر¬های دستگاه، شناسایی نشوند.
• در هنگام تفسیر نتایج الکتروفورز، بررسی CBC و سن بیمار بسیار حائز اهمیت می¬باشد و این نکته در الگوهای مورد مطالعه به خوبی قابل مشاهده است، چرا که بسیاری از الگوها مشابه یکدیگر می¬باشند ولی سن بیمار و ایندکس های خونی فرد، باعث تفسیر¬های متفاوتی می¬شود.
• اگر در بررسی باند¬های الکتروفورز، تناقض بین ژل و ایندکس¬های CBC بیمار مشاهده گردید، اولین گام بررسی سابقه تزریق خون در حداقل دو ماه گذشته توسط بیمار می¬باشد، زیرا خون¬های اهدایی ممکن است دارای واریانت¬هایی باشند که در خون بیمار ادغام شده و در هنگام الکتروفورز باعث ایجاد خطا گردند.
• بررسی CBC و الگوی الکتروفورز والدین در اغلب اوقات به عنوان ارزانترین، ساده¬ترین و کاربردی¬ترین روش جهت تفسیر نتایج الکتروفورز می¬باشد.
• گاهی اوقات علت کم¬خونی بیمار مربوط به عواملی غیر از تالاسمی¬ها و هموگلوبینوپاتی¬ها، از¬جمله کم¬خونی¬های فقر¬آهن، نقص¬های آنزیم¬های RBC مثل G6PD یا Pyruvate Kinase deficiency می¬باشد.
• از آنجایی که اساس هموگلوبین الکتروفورز بر پایه pH ایزوالکتریک می¬باشد، لذا توجه به pH بافر و تنظیم بودن آن بسیار حائز اهمیت است، زیرا تغییر در pH بافر ممکن است باعث عدم جداسازی دقیق هموگلوبین¬ها از یکدیگر گردد.
• الگوی الکتروفورز در آلفا تالاسمی¬ها به جز بیماری هموگلوبین H، همیشه نرمال می¬باشد، تنها ممکن است تغییرات جزئی در ایندکس¬هایCBC بیمار مشاهده گردد، بنابراین جهت تایید نهایی آلفا تالاسمی¬ها حتماً می¬بایست از روش-های مولکولی استفاده نمود.
• همراه بودن سندرم¬های آلفا تالاسمی با بتا تالاسمی معمولاً در الگوی الکتروفورز بتا تالاسمی بیمار تاثیر چشمگیری ندارند، به عنوان مثال همراهی بیماری هموگلوبین H با بتا تالاسمی ماینور، تاثیر چندانی در کاهش هموگلوبین A2 ندارد. اما در افراد دارای هموگلوبین A2 لب مرزی همانند کم¬خونی فقر¬آهن، ممکن است A2 نرمال شود.
• همیشه بتا تالاسمی ماینور با افزایش هموگلوبین A2 و یا کاهش MCV همراه نیست و به دلایل مختلف ممکن است این فاکتور¬ها را به شکل معمول مشاهده نکنیم؛ به عنوان مثال همراه بودن بتا تالاسمی ماینور با یک آلفا تالاسمی به دلیل ایجاد بالانس بین گلوبین¬های آلفا و بتا ممکن است با MCV نزدیک به نرمال همراه شود یا بعضی از جهش¬های ژن بتا که در ناحیه پروموتور رخ می¬دهد ممکن است بدون افزایش هموگلوبین A2 و یا کاهش MCV همراه باشد و گاهاً با CBC و الکتروفورز کاملاً نرمال همراه می¬باشد مثل جهش -92(C>T) یا برخی از جهش¬ها با افزایش هموگلوبین A2 و بدون کاهش MCV همراه می¬باشند مثل جهش -88(C>T)
• برخی مواقع ممکن است بتا تالاسمی با دلتا تالاسمی توام باشد و همین امر نیز باعث کاهش هموگلوبین A2 می¬گردد، به عنوان مثال در حالت هموزیگوت دلتا تالاسمی میزان غلظت A2 به صفر می¬رسد و در عین حال ممکن است بیمار بتا تالاسمی باشد.
• همیشه افزایش تعداد RBC و کاهش MCV و MCH با تالاسمی همراه است.
• وجود واریانت¬ها ممکن است درCBC بیمار تغییری ایجاد نکند، بنابراین صرفاً با یک CBC طبیعی نمی¬توان وجود هموگلوبینوپاتی¬ها را در بیمار رد نمود.
• همیشه کاهش تولید زنجیره¬های گلوبین باعث بر¬هم خوردن تعادل بین گلوبین¬ها و به دنبال آن کاهش MCV بیمار نمی¬گردد، گاهی افزایش تولید یک گلوبین علت این موضوع است مثل Triple Alpha (ααα) که با افزایش تولید گلوبین آلفا باعث بر¬هم خوردن تعادل بین گلوبین¬های آلفا و بتا و کاهش MCV بیمار می¬گردد.
• بر خلاف تصور، گاهی اوقات با وجودی که یکی از زوجین از نظرسندروم¬های آلفا و بتا تالاسمی کاملاً سالم است، در فرزندان وی تالاسمی¬ تا حد اینترمدیا مشاهده می¬گردد. به مثال زیر توجه نمایید
o شخصی را در نظر بگیرید که از نظر آلفا و بتا تالاسمی کاملا سالم است (, αα/ααβ/β) و همسر ایشان دارای همراهی بتا تالاسمی ماینور و سایلنت آلفا و Triple Alpha می¬باشد (, ααα/-αβ0/β). والد اخیر از نظر آلفا تالاسمی ظاهراً سالم به نظر می¬رسد چرا که دارای چهار ژن آلفای فعال می¬باشد و به لحاظ تولید گلوبین آلفا مشکلی ندارد و بنابراین تعادل بین گلوبین¬های آلفا و بتا به دلیل تالاسمی ماینور بتا بهم خورده و با کاهش شدید MCV همراه می¬باشد، در واقع الگوی CBC و الکتروفورز این بیمار صرفاً یک ماینور بتا تالاسمی را نشان می¬دهد در صورتی که انتظار می¬رود در همراهی آلفا و بتا تالاسمی با یکدیگر به دلیل برقراری تعادل بین زنجیره¬ها، MCV بیمار کاهش چشمگیری نداشته باشد. در فرزندان این زوج ممکن است توارث ژنی به این صورت باشد: β0/β و ααα/αα، در واقع این بیمار همزمان ژن ناقل بتا تالاسمی و Triple Alpha را از والد خود به ارث می¬برد و در این صورت بیمار دارای پنج ژن فعال آلفا و تنها یک ژن فعال بتا می¬باشد، بنابراین بالانس بین زنجیره¬های آلفا و بتا به شدت بهم¬خورده و می¬تواند ایجاد تالاسمی اینترمدیا نماید، لذا والد سالم می¬بایست دارای هموزیگوت +α(-α/-α) باشد تا فرزندان ایشان دچار تالاسمی اینترمدیا نگردند.
• در مورد بتا واریانت¬ها این نکته قابل توجه می¬باشد که سرعت حرکت این واریانت¬ها در مقایسه با هموگلوبین A1 در pH آلکالینی با غلظت آنها نسبت مستقیم دارد، منظور این است که اگر یک بتا واریانت کندتر از هموگلوبین A1 حرکت نماید غلظت آن نیز کمتر از A1 خواهد بود مثل هموگلوبینS و D و بالعکس اگر واریانت سریع¬تر از هموگلوبین A1 حرکت کند غلظت آن نیز بیشتر از A1 خواهد بود مثل هموگلوبین J Iran. علت این موضوع مربوط می¬شود به پیوند بین گلوبین¬های آلفا و بتا که گلوبین بتا به شدت دارای بار منفی و گلوبین آلفا دارای بار مثبت است و همین موضوع سبب برقراری پیوند بین این دو گلوبین می¬گردد. حال زمانیکه گلوبین بتا دچار جهش شده و بار الکتریکی آن تغییر نماید به عنوان مثال در مورد هموگلوبین S که بار منفی گلوبین بتای آن کمتر از گلوبین بتای سالم می¬شود، لذا هم قدرت پیوند آن با گلوبین آلفا کمتر شده و هم به دلیل بار منفی کمتر نسبت به بتای سالم حرکت الکتروفورتیک آن به سمت قطب مثبت نسبت به هموگلوبین A1کمتر خواهد بود. از این نکته می¬توان در تشخیص غلظت واریانت¬ها استفاده نمود، البته این موضوع به شرطی صحیح می¬باشد که این واریانت¬ها در حالت هتروزیگوت باشند و ژن بتای دیگر کاملاً سالم باشد.
• بتا واریانت¬ها در حالت هتروزیگوت بین 25 تا 40% و آلفا واریانت¬ها در حالت هتروزیگوت کمتر از 20% می¬باشند. از همین نکته می¬توان در جداسازی بتا واریانت¬ها از آلفا واریانت¬ها استفاده نمود.
• در مورد آلفا واریانت¬ها اکثر مواقع فقط تشخیص اینکه هموگلوبین مورد نظر آلفا واریانت می¬باشد کفایت می¬کند و نیازی به مشخص نمودن اسم واریانت نیست زیرا اغلب آنها به لحاظ فنوتیپی مشابه یکدیگرند.
• اضافه¬های گلوبین بتا و گاما در بیماری هموگلوبین H می¬توانند به صورت تترامر درآمده و ایجاد هموگلوبین¬های H و بارت نماید در صورتیکه آلفا¬های اضافه در بتا تالاسمی¬ها در غشا RBC رسوب کرده و سپس اکسید می¬شوند ولی در الکتروفورز چیزی مشاهده نمی¬شود.
• بعضی از بتا واریانت¬ها از جمله هموگلوبین S در زمان کمبود گلوبین آلفا نمی¬توانند فرم تترامری تشکیل دهند، منظور این است که زمانی که بیمار دارای همراهی هموزیگوت S و بیماری هموگلوبین H باشد، اضافات گلوبین S تشکیل هموگلوبین H نمی¬دهد، لذا باند H هم مشاهده نمی¬گردد. همچنین در حالت همراهی هتروزیگوت این واریانت با بیماری هموگلوبین H نیز به دلیل کمبود گلوبین بتای سالم، باند H مشاهده نمی¬گردد. این نکته در مورد همراهی بتا تالاسمی ماینور با بیماری هموگلوبین H نیز صادق است. بنابراین هموگلوبین H معمولاً زمانی مشاهده می¬گردد که هر دو ژن بتا کاملاً سالم باشند.
• در صورت مشاهده¬ی هموگلوبین F مخصوصا در غلظت¬های بیش از 10 درصد حتما می¬بایست وجود این هموگلوبین با روشAlkalin denaturation تایید گردد، زیرا بعضی از واریانت¬ها در این ناحیه حرکت می¬کنند.
• در موارد خیلی نادر ممکن است در یک ژن بتا به طور هم¬زمان علاوه بر وجود یک واریانت، یک جهش از نوع +β رخ داده باشد که این موضوع باعث می¬شود درصد بتا واریانت به حدود 10 درصد برسد و با آلفا واریانت¬ها اشتباه گرفته شود. الگوی الکتروفورز والدین در چنین مواردی کمک¬کننده نمی¬باشد و تنها راه تشخیص آن، انجام تست¬های مولکولی می-باشد، اما در اغلب اوقات در چنین مواردی با کاهش MCV و افزایش هموگلوبین A2 روبرو هستیم (مشابه بتا تالاسمی ماینور).
• حداقل غلظت هموگلوبین S لازم جهت مثبت شدن تست حلالیت، حدود 20 درصد می¬باشد. غلظت هموگلوبین S کمتر از 20 درصد ممکن است با این روش منفی شود.
• گلوبین¬های آلفا واریانت¬ها می¬تواند علاوه بر پیوند با گلوبین بتا، با گلوبین¬های گاما و دلتا نیز باند شده و ایجادF Variant وA2 Variant نماید. بنابراین ممکن است در نوزادان واریانت¬هایی مشاهده شود که بعد از بلوغ و جایگزین شدن زنجیره¬ها، این واریانت از بین رفته و واریانت دیگری جایگزین گردد.
• در مواقعی که به طور همزمان آلفا واریانت و A2 واریانت در نمونه بیمار مشاهده می¬شود اگر نسبت A1 به آلفا واریانت برابر با نسبت A2 به A2 واریانت باشد، می¬توان گفت که A2 واریانت مربوط به ژن دلتا نمی¬باشد و در واقع 2δ2V α می-باشد. اگر A2 واریانت مربوط به جهش در ژن دلتا باشد معمولاً میزان آن با میزان A2 برابر است و مجموع این دو با یکدیگر به عنوان درصد نهایی A2 بیمار می¬باشد.
• زمانی که بیمار دارای هموگلوبین A2واریانت باشد، مجموع هموگلوبین A2 و A2واریانت بعنوان درصد نهایی هموگلوبین A2 بیمار تلقی می¬شود و اگر مجموع آن بیشتر از حد نرمال باشد، بیمار دارای ماینور بتا تالاسمی نیز هست.
• در بیمارانی که میزان F بالایی دارند و همزمان دارای یک آلفا واریانت نیز می¬باشند، احتمال حضور F واریانت نیز وجود دارد که در این حالت، نسبت A1 به آلفا واریانت برابر با نسبت F به F واریانت می¬باشد.
• در نوزادان به دلیل فعالیت اندک ژن دلتا و بتا ممکن است واریانت¬ها یا دیده نشوند و یا با درصد¬های بسیار پایین¬تر از حد واقعی مشاهده گردند. بنابراین تفسیر نتایج الکتروفورز نوزادان تا قبل از شش ماهگی ممکن است صحیح نباشد.
• هموگلوبین H در نوزادان تازه متولد شده که دارای بیماری هموگلوبین H می¬باشند ممکن است مشاهده نشود و بجای آن هموگلوبین بارت دیده شود، ولی بعد از بلوغ هموگلوبین بارت از بین رفته و هموگلوبین H جایگزین می¬شود.
• در همراهی هموزیگوت HPFH با یک واریانت آلفا، در الگوی الکتروفورز بیمار ممکن است علاوه بر باند هموگلوبین F، یک باند دیگر مربوط به F واریانت نیز مشاهده گردد.
• حضور همزمان آلفا واریانت¬ها با بتا واریانت¬ها می¬تواند علاوه بر تولید این دو واریانت، ایجاد هموگلوبین دیگری تحت عنوان هموگلوبین هیبرید نماید که ممکن است این هموگلوبین در الگوی الکتروفورز والدین نباشد.
• بعضی از واریانت¬ها از جمله هموگلوبین H و هموگلوبین Constant Spring ناپایدار هستند و در محیط آزمایشگاه تخریب شده و از بین می¬روند، بنابراین انجام هموگلوبین الکتروفورز بر روی نمونه¬های کهنه ممکن است باعث از دست -رفتن این واریانت¬ها شود یا ممکن است به ¬صورت اسمیر دیده شود.
• هموگلوبین¬های S تخریب شده در الکتروفورز استات سلولز به صورت یک باند، کمی جلوتر از هموگلوبین S و نزدیک به هموگلوبین F مشاهده می¬شوند، بنابراین انجام الکتروفورز بر روی نمونه¬های کهنه¬ی حاوی S می¬تواند باعث افزایش غلظت این باند و تداخل آن با هموگلوبین F گردد.
• در انجام تست حلالیت جهت وجود هموگلوبین S می¬بایست بعد از پنج دقیقه، نتیجه آزمایش خوانده شود، زیرا در مواردی که درصد این هموگلوبین کم باشد ممکن است در دقایق اولیه نتیجه منفی باشد.
• در الگوی هتروزیگوت بتا واریانت¬ها هیچ¬گاه درصد آنها بیشتر از هموگلوبین A1 نخواهد بود مگر در مواردی که این واریانت¬ها با یک +β به صورت ترانس همراه باشند. در مورد هموگلوبین J Iran این موضوع بر عکس می¬باشد و درصد آن بیشتر از A1 است.
• در همزمانی دو واریانت بتا در یک فرد، میزان هموگلوبین A1 صفر درصد می¬باشد و در اسکن الگوی الکتروفورز این بیمار باید به این نکته توجه نمود که حضور حتی یک درصد هموگلوبین A1 به معنی تغییر در تفسیر الگوی تالاسمی بیمار است و در واقع اشتباه می¬باشد.
• الگوهای اینترمدیا، ماژور و ... بر اساس فنوتیپ بیمار گزارش می¬شوند نه بر اساس ژنوتیپ. به عنوان مثال ممکن است شخصی از لحاظ ژنتیکی در رده تالاسمی ماژور بتا باشد ولی چون وابسته به تزریق خون نیست، وی را در رده تالاسمی اینترمدیا دسته¬بندی می¬کنند. در هموزیگوت هموگلوبین لپور هم علیرغم وجود نقص در هر دو ژن بتا، بدلیل تولید نسبتاً زیاد هموگلوبین F، بیمار در رده تالاسمی اینترمدیا قرار می¬گیرد و وابسته به تزریق خون نمی¬باشد.
• هموگلوبین F بیشتر از 10 درصد می¬تواند بطور کاذب نتیجه تست Unstable Hb را مثبت نماید، بنابراین قبل از انجام تست Unstable Hb می¬بایست حتما هموگلوبین-الکتروفورز جهت بیمار انجام گردد و میزان هموگلوبین F بررسی شود. همچنین انجام تست Unstable Hb جهت نوزادان، بدلیل میزان بالای هموگلوبین F امکان¬پذیر نمی¬باشد.


